I. PENDAHULUAN
Kerapkali kita melihat bahwa buah apel, pir, kentang atau salak, yang baru saja dikupas, daging buah atau umbinya menjadi berwarna coklat. Apa sebenarnya yang terjadi di balik itu semua? Apakah gejala itu menguntungkan atau sebaliknya, merugikan? Dalam ilmu pangan, gejala itu dinamai browning atau pencoklatan. Yaitu, terbentuknya warna coklat pada bahan pangan secara alami atau karena proses tertentu dan yang pasti bukan akibat zat warna31.
Pada kelompok makanan tertentu, seperti pada produk bakery (berbagai roti, snack, kacang-kacangan, daging panggang, kopi, teh, dan pada permen coklat) browning umumnya diminati. Sebaliknya, pada kelompok buah-buahan seperti apel, pir, salak dan juga kentang, proses pencoklatan itu nampaknya tak dikehendaki. Pencoklatan pada buah apel dan buah lain setelah dikupas disebabkan oleh pengaruh aktivitas enzim Polypenol Oxidase (PPO), yang dengan bantuan oksigen akan mengubah gugus monophenol menjadi O-hidroksi phenol, yang selanjutnya diubah lagi menjadi O-kuinon. Gugus O-kuinon inilah yang membentuk warna coklata. Uraian dua paragraf ini adalah sebagai ilustrasi tentang fenol dalam enzim dan aktifitasnya.
Untuk mencegah terbentuknya warna coklat pada buah-buah itu, kita dapat melakukannya dengan cara blanching atau pemanasan. Caranya, setelah dikupas dan dipotong-potong, buah apel direndam dalam air panas (suhu 82-93 derajat Celcius) atau dikenai uap air panas selama 3 menit. Selanjutnya, direndam dalam larutan vitamin C, dengan ukuran 200 miligram per liter (dalam 1 liter air diberi tablet kecil vitamin C). Maksudnya, untuk menonaktifkan enzim penyebab pencoklatan itu. Dengan demikian Anda akan mendapatkan apel yang tetap segar penampilannya dan memperoleh tambahan vitamin C dalam buah tersebut31.
Penelitian lain telah dilakukan terhadap munculnya warna coklat pada minyak kelapa sawit. Pigmen coklat biasanya hanya terdapat pada minyak yang berasal dari bahan yang telah busuk atau memar. Hal ini dapat terjadi karena reaksi molekul karbohidrat dengan gugus pereduksi seperti aldehid serta gugus amin dari molekul protein dan yang disebabkan oleh karena aktivitas enzim-enzim seperti phenol oxidase, poliphenol oxidase dan sebagainya33.
Aktifitas senyawa fenol yang lain adalah dalam limbah cair buangan industri pulp kertas sebagai senyawa toksik dan sumber pencemaran lingkungan. Sebenarnya, fenol merupakan senyawa kimia yang harganya cukup tinggi, karena penggunaannya yang cukup luas diantaranya untuk pembuatan perekat kayu lapis fenol formaldehida. Beberapa penelitian telah dilakukan dalam tiga tahap, yakni (1) Penelitian rendemen distilasi fenol dari lindi hitam (2) Penelitian untuk memilih jenis senyawa fenol pencampur fenol distilat (3) Penelitian rasio optimum fenol distilat dengan pencampur pada pembuatan perekat fenol forrnaldehida. Rendemen distilasi fenol dan lindi hitam limbah proses pulping alkali (soda) yang mengandung fenol terikat sebesar 2898,3 ppm adalah 12,0 % (347,2 ppm). Jenis fenol yang diteliti sebagai pencampur fenol distilat adalah fenol kristal dan tanin. Kedua jenis fenol tersebut dicampur dengan fenol distilat dalam perbandingan 1:3; 1:5 dan 1:7. Kemudian dibuat perekat fenol formaldehida mengikuti prosedur baku menggunakan pereaksi formalin. Perekat tersebut dicobakan pada kayu lapis dan diuji kadar air, kerapatan dan keteguhan rekat. Hasil penelitian menunjukkan penggunaan senyawa fenol sebagai pencampur lebih baik dari tanin karena lebih rendah dalam kadar air, lebih tinggi dalam kerapatan dan keteguhan rekat. Pada semua rasio campuran, kekuatan rekat dari tanin lebih rendah dari standar minimal yaitu 14 kg/cm2. Penggunaan pencampur senyawa fenol memberikan hasil yang lebih tinggi dari standar minimal (18 – 24 kg/cm2)32.
II. KARAKTERISTIK FENOL
Fenol atau asam karbolat atau benzenol adalah zat kristal tak berwarna yang memiliki bau khas. Rumus kimianya adalah C6H5OH dan strukturnya memiliki gugus hidroksil (-OH) yang berikatan dengan cincin fenil. Kata fenol juga merujuk pada beberapa zat yang memiliki cincin aromatik yang berikatan dengan gugus hidroksil. Fenol memiliki kelarutan terbatas dalam air, yakni 8,3 gram/100 ml. Fenol memiliki sifat yang cenderung asam, artinya dapat melepaskan ion H+ dari gugus hidroksilnya. Pengeluaran ion tersebut menjadikan anion fenoksida C6H5O− yang dapat dilarutkan dalam air.34
Dibandingkan dengan alkohol alifatik lainnya, fenol bersifat lebih asam. Hal ini dibuktikan dengan mereaksikan fenol dengan NaOH, di mana fenol dapat melepaskan H+. Pada keadaan yang sama, alkohol alifatik lainnya tidak dapat bereaksi seperti itu. Pelepasan ini diakibatkan pelengkapan orbital antara satu-satunya pasangan oksigen dan sistem aromatik, yang mendelokalisasi beban negatif melalui cincin tersebut dan menstabilkan anionnya.
Fenol didapatkan melalui oksidasi sebagian pada benzena atau asam benzoat dengan proses Raschig. Fenol juga dapat diperoleh sebagai hasil dari oksidasi batu bara. Fenol merupakan komponen utama pada antiseptik dagang, triklorofenol atau dikenal sebagai TCP (trichlorophenol). Fenol juga merupakan bagian komposisi beberapa anestitika oral, misalnya semprotan kloraseptik. Fenol berfungsi dalam pembuatan obat-obatan (bagian dari produksi aspirin, pembasmi rumput liar, dan lainnya). Fenol yang terkonsentrasi dapat mengakibatkan pembakaran kimiawi pada kulit yang terbuka. Rumus bangun fenol dapat dilihat pada gambar di bawah ini.
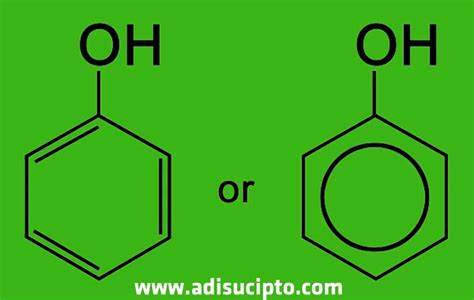 Rumus bangun fenol
Rumus bangun fenol
Fenol merupakan komponen utama pada anstiseptik dagang, triklorofenol atau dikenal sebagai TCP (trichlorophenol). Fenol juga merupakan bagian komposisi beberapa anestitika oral, misalnya semprotan kloraseptik. Fenol berfungsi dalam pembuatan obat-obatan (bagian dari produksi aspirin) pembasmi rumput liar, dan lainnya. Fenol yang terkonsentrasi dapat mengakibatkan pembakaran kimiawi pada kulit yang terbuka.
Senyawa fenol dapat pula ditemukan di perairan. Keberadaanya dapat menjadi sumber pencemar yang membahayakan kehidupan manusia maupun hewan air lainnya. Batas maksimum yang diperbolehkan untuk air minum maupun air bersih adalah 0,0002 ppm7. Berdasarkan beberapa percobaan, senyawa fenol dengan iodium monobromida, reksinya dapat berlangsung dalam suasana asam maupun netral. Dalam suasana netral, reaksinya berlansung lambat, yakni 85 menit pada suhu 45 oC dan 8-10 jam pada suhu kamar. Namun dalam suasana asam kuat, reaksinya akan berlangsung cepat (hanya 10 menit).
Ketertarikan akan fenol murni dalam tubuh hewan dimulai karena adanya penemuan fenol dalam urin kuda, sapi dan manusia. Retensi fenol dalam jaringan hewan, paling tidak telah dumulai penelitiannya sebelum tahun 1944 oleh deMeio dan Arnolt. Dengan menggunakan media krebs’ solution dengan pH = 7.2, phosphate buffer, 0,2 gram glukosa per 100 ml., 0,5 mg fenol dalam 100 ml. Gas phase, oxygen; waktu inkubasi, 2 jam. Volume larutan tiap, 15 ml.
III. AKTIFITAS FENOL
Aktifitas fenol seringkali dimanfaatkan sebagai bahan untuk penelitian. Penelitian tentang dampak asam-asam fenolic terhadap pertumbuhan dan kelangsungan hidup Oenococcus oeni dan Lactobacillus hilgardii menunjukkan bahwa umumnya asam fenolic tidak memiliki efek negatif terhadap pertumbuhan O. Oeni , sedangkan pada L. hilgardii efeknya hanya dari jenis asam p-coumaric. Secara umum, O. Oeni lebih sensitif dari L. hilgardii untuk asam fenolic inaktifasi2.
Senyawa fenol seringkali digunakan untuk pengukuran konsentrasi karbohidrat dan protein dalam metode asam sulfur 1, 10, percobaan uji sensitifitas biomarker pada ikan medaka, Oryzias latipes untuk kemudian dilakukan pengukuran ekspresi gennya pada level choriogenin, vitellogenin dan reseptor estrogen dengan reverse trancription-polymerase chain reaction (RT-PCR)9, pencucian sel pada ikan atlantik salmon dalam pengujian laboratorium8, pencucian macrophage monolayer dalam uji chemiluminescence (CL) pada ikan turbot (Scophthalmus maximus,L.) terhadap respon immun non spesifik setelah diinfeksi dengan Vibrio pelagius13, perendaman kelenjar pituitari ikan indian major carp dalam larutan guanidium thiocyanate-phenolchloroform (GTC) untuk dalam tahapan isolasi RNA12, untuk mendapatkan ekstrak DNA dalam metode fenol-chloroform4,11,19 atau pengujian ekspresi enzim metionin sulfoksid reduktase A (MsrA) yang terkandung dalam bakteri16.
Penelitian lain adalah tentang uji toksisitas dari 11 bahan kimia sintetik dengan menggunakan suspensi sel kultur. Ke sebelas bahan kimia tersebut adalah benzentonium klorid, sodium dodesilsulfat, captan, sodium linear-dodesilbenzensupfonat, bentiocarb, MEP, diazinon, asam asetat, fenol, anilin dan etanol. Berdasarkan hasil uji terhadap sel CHSE-sp, senyawa fenol sebenarnya menduduki urutan ke-9 berdasarkan urutan benzentonium klorid >sodium dodesilsulfat >captan >sodium linear-dodesilbenzen-supfonat> bentiocarb> MEP> diazinon> asam asetat> fenol> anilin> etanol20. Penelitian tersebut memang belum berhasil mengungkap semua bahan kimia yang berbahaya bagi sel ikan kultur yang disinyalir lebih dari 100 jenis bahan, namun paling tidak dapat digunakan sebagai gambaran posisi toksisitas dari fenol terhadap sel ikan kultur.
Senyawa fenol yang lain sebenarnya banyak terdapat dalam daun teh atau ekstrak teh. Salah satu jenisnya adalah katesin (catechin). Keberadaannya sebagai antioksidan telah banyak diteliti dampak fisiologisnya terhadap kesehatan manusia. Katesin juga banyak dijumpai dalam anggur, cokelat, buah-buahan, sayuran dan rumput laut Jepang 21,22. Penelitian di Indonesia dilakukan terhadap tanaman lada, nilam dan terung dalam hal kandungan fenol dan hubungannya dengan ketahanan terhadap penyakit yang biasa menyerang jenis tanaman tersebut. Hasil penelitian menunjukkan bahwa tanaman yang tahan mempunyai kandungan fenol dan lignin yang lebih tinggi bila dibandingkan dengan tanaman yang rentan27.
Dalam bentuknya sebagai betulinol yang biasa terdapat dalam kayu, telah dicobakan untuk mengetahui dampaknya dalam reproduksi zebrafish, Danio rerio (Hamilton). Pada dosis 5 μg/l selama 8 minggu pada ikan betina, mampu meningkatkan intensitas pemijahan, sedangkan pada jantan mampu meningkatkan munculnya perubahan struktur dalam testes. Namun demikian, setelah ikan-ikan tersebut diinfeksi dengan bakteri maka dapat diketahui bahwa daya immunenya melemah. Studi ini mengindikasikan bahwa betulinol diduga memiliki efek pengganguan-endokrin pada zebrafish, namun meningkatnya kecendrungan terjadinya kelainan secara struktural dalam testes diduga disebabkan oleh aksi sinergitik antara komponen dalam testes dan adanya infeksi bakteri23.
Sebagai senyawa dengan sifat toksisitas tertentu, Jepang telah melakukan penelitian untuk mengetahui proses degradasi senyawa nonilfenol (NP) di beberapa perairannya dengan menggunakan mikroba consortia. Penelitian dilakukan di teluk Tokyo dan unit pengolahan limbah. Senyawa NP didegradasi dalam waktu 45 hari pada suhu 25 oC dalam medium mengandung NP (1000 ppm) sebagai sumber karbon. Penelitian dengan sample mikroba lain, menunjukkan bahwa proses degradasinya selama 30 hari. Dengan medium yang mengandung NP/glukosa dengan rasio 1, aktivitas degradasinya ternyata tidak dipengaruhi oleh adanya glukosa25.
Bagi Indonesia, industri yang berkembang cepat, limbah rumah tangga yang semakin berlimpah ruah berakibat pada munculnya pencemaran dan dapat dipastikan akan meningkat pula dari tahun ke tahun. Walaupun sejumlah usaha telah dilakukan Pemerintah untuk mengatasi masalah ini, namun kesadaran masyarakat yang masih rendah merupakan kendala utama, sehingga tidak berjalannya beberapa program Pemerintah dalam penanggulangan limbah tersebut.
Fenol dan derivat-derivatnya merupakan polutan yang sangat berbahaya di lingkungan karena bersifat racun dan sangat sulit didegradasi oleh organisme pengurai. Fenol adalah senyawa kimia yang bersifat korosif yang dapat menyebabkan iritasi jaringan, kulit, mata dan mengganggu pernapasan manusia. Nilai ambang batas senyawa fenol untuk baku mutu air minum sebesar 0,001 ppm, mutu buangan air industri sebesar 0,3 ppm serta di lingkungan para pekerja gas fenol adalah 0,3 ppm2. Fenol di alam mengalami transformasi kimia, biokimia, dan fisika. Namun proses alami saja tidak cukup untuk menuntaskan permasalahan yang timbul. Hal yang menimbulkan permasalahan harus segera diatasi sehingga fenol dan derivat-derivatnya perlu ditiadakan atau dikurangi sampai dengan nilai batas ambangnya. Manfaatnya adalah mencoba mengurangi bahaya yang ditimbulkan oleh fenol, yaitu terbentuknya senyawa hasil degradasi yang tidak membahayakan atau menimbulkan racun di alam.
Penelitian biodegradasi ini dilakukan pada skala laboratorium29, yang difokuskan pada pemecahan komponen tunggal dengan menggunakan kultur murni. Fenol merupakan racun protoplasmik yang toksik terhadap segala jenis sel. Kadar fenol yang tinggi akan mengendapkan protein, sedangkan kadar rendah akan mendenaturasi protein tanpa koagulasi. Biodegradasi fenol adalah terjadinya pengrusakkan cincin aromatik oleh mikroba pada proses anaerobik dan aerobik. Senyawa aromatik baik secara total maupun sebagian dapat didegradasi oleh mikroorganisme tergantung pada jumlah cincin dan jenis substituennya. Reaksireaksinya meliputi:
- Infiltrasi kedalam sel, apabila tidak ada resistensi dalam terhadap transportasi massa dan biomassa terdistribusi serba sama melalui medium,
- Transformasi sisi rantai, dan
- Modifikasi pensubstitusi dan perubahan senyawa-senyawa aromatik.
Pengukuran kadar fenol sisa hasil degradasi dilaksanakan tiap 24 jam sekali selama 10 hari. Pengukuran dilaksanakan dengan metoda kolorimetri setelah pemisahan biomassa dengan menggunakan sentrifuge kecepatan 3000 rpm. Tata cara kerja pengukuran, yaitu dengan mengencerkan 1 mL menjadi 100 mL, diberi 2,5 mL NH4OH 0,5 M, kemudian diaduk dengan pengaduk dan ditambahkan larutan penyangga fosfat pH 6,8 sehingga pH larutan menjadi 10,2, kemudian ditambahkan lagi 1 mL 4-aminoantipirin 2 % dan kalium Ferrisianida 8 %, larutan akan berwarna merah, diaduk selama 15 menit, kemudian diukur, yaitu dibaca serapannya pada panjang gelombang yang telah didapatkan. Hal yang sama dilakukan pada pengukuran pelarut blanko tanpa senyawa fenol.
IV. FENOL DALAM AKTIFITAS ENZIM
Enzim merupakan protein yang dihasilkan oleh sel hidup yang bertindak sebagai katalis dalam reaksi kimia organik, yang dapat mengubah bahan sedangkan dia sendiri tidak mengalami perubahan. Enzim tersebut dapat terus bekerja setelah kematian organisme. Berkaitan dengan hal tersebut, kinerja fenol dalam enzim, telah dilaporkan oleh beberapa peneliti dengan objek percobaan yang berbeda-beda. Sebagai senyawa aromatic, fenol -bila ingin dihilangkan keberadaanya-, dapat dihilangkan dengan menggunakan enzim extra-cellular peroksidase dengan pH optimal 7-8. Pada pH netral, proses tersebut meningkat, namun mengalami penurunan seiring dengan meningkatnya suhu dari 0 -30 oC6.
Kentang (Solanum tuberosum) mudah sekali mengalami pencoklatan (browning), bila penenganannya kurang baik , salah satu factor yang mempengaruhi adalah asam askorbat, tirosin, enzim polifenol oksidase dan oksigen yang tersedia. Reaksi pencoklatan dapat terjadi melalui dua proses yaitu proses pencoklatan enzimatik, disebabkan adanya enzim PPO dan tirosin yang berperan sebagai substrat sedangkan proses non enzimatis disebabkan karena reaksi Meillard, karamelisasi atau oksidasi asam askorbat (Richardson, 1983 dalam18). Proses pencoklatan yang terjadi kan mengurangi kualitas produk dan menurunkan minat konsumen (Friedman,1990 dalam18). Pada penelitian ini dicoba mempelajari proses yang terjadi apakah proses enzimatik atau non enzimatik, dengan menggunakan dua jenis kentang varietas Wonosobo dan Tawangmangu. Proses pencoklatan sebenarnya dimulai dari kentang yang dikupas, dipotong-potong, oksidasi asam askorbat, senyawa phenol seperti senyawa tirosin sebagai substrat, akan dikatalisis enzim PPO menjadi quinon dan berpolimerisasi membentuk o quinon, sehingga menghasilkan warna kecoklatan. Penentuan asam askorbat dalam varietas kentang digunakan untuk proses penghambatan pencoklatan kentang atau proses browning (inhibitor), karena menurut Mondy,1993, asam askorbat dapat menghambat enzim PPO pembentuk melanin. Metode yang digunakan adalah metode spektrofotometri untuk menentukan tirosin, sedangkan metoda Murshell Soil Colour Chart digunakan untuk menentukan asam askorbat, aktivitas enzim PPO dan perubahan warna kentang18.
Pada penelitian kentang tersebut, kadar tirosin dianggap tidak ikut berperan penting pada perubahan warna kentang karena kadar tirosin hampir sama. Reaksi pencoklatan dapat juga terjadi dengan fenol lainnya yaitu asam klorogenat. Bila dilihat kandungan asam askorbat yang sangat berbeda sekali , varietas Wonosobo cenderung berperan sebagai reaksi non enzimatis dapat dihubungkan dengan perubahan warna yang lebih lama dibandingkan varietas Tawangmangu. Asam askorbat dapat berfungsi pada reaksi enzimatik dan non enzimatik. Aktivitas kedua varietas sangat berbeda, jika aktivitas besar, maka perubahan warna akan cepat, tapi hasil penelitian berbeda, varietas Wonosobo lebih lama dibandingkan varietas Tawangmangu perubahan warnanya. Jadi pada penelitian ini enzim tidak merupakan indikator pada perubahan warna kentang18.
Indikator sulfonephthalein, phenol merah memperlihatkan hal yang tidak umum dari oksidasi oleh laccase pada Poliporus pinsitus bahwa fenol merupakan substrat alami dari enzim phenoloxidase. Fenol tersebut mengalami oksidasi sebanyak 90% selama 24 jam dengan katalis laccase. Penelitian tersebut juga telah menunjukkan bahwa phenol merah 10 kali lebih efisien daripada 3-hydroxyanthranilate (a reported natural phenolic mediator of laccase) dalam mengoksidasi 4-methoxybenzyl alkohol17.
Penelitian lain tentang penggunaan fenol sebagai substrat berbagai reaksi enzimatis juga dilakukan, misalnya 2,4,6-tri(But)-phenol untuk melihat mekanisme dan isu steric dalam oksidasi senyawa fenol dan non fenol dengan menggunakan laccase atau sistem mediator laccase. Fragmen radikal dari fenoksil dihasilkan oleh laccase dari lignin atau residu monomer fenolik atau darivat lignin yang dioksidasi dengan enzim ligninolitik lain15. Glukosa oksidase (EC 1.1.3.4) umumnya ditemukan dalam bentuk lignoselolose hasil penguraian jamur dan fenol oksidase, selolase dan glukosidase, dimana suplay oksigen pada saat itu sangat minim. Studi spectrophotometrik dapat menjelaskan adanya interaksi antara glukosa oksidase dengan transitory quinon dan hasil oksidasi radikal bebas lignol yang dapat digunakan sebagai co-substrat untuk mereduksi flavoenzim pada kondisi kandungan oksigen rendah30.
Hasil penelitian tentang isolasi dan karakterisasi sebagian enzim multikomponen fenol hydroksilase terhadap pertumbuhan Acinetobacter radioresistens S13 pada fenol sebagai sumber karbon dan energi. Secara umum enzim tersebut meliputi oxygenase (PHO), reductase ( PHR) dan regulatori ( PHI). PHR mengandung FAD dan ironsulfur cluster yang berfungsi dalam transfer elektron dari NADH ke oksigenase dinuclear iron centre. PHI diperlukan sebagai katalis dalam proses konfersi fenol menjadi katekol in vitro, tetapi tidak diperlukan untuk aktifitas PHR3. Penelitian lain dilakukan dengan memanfaatkan bromofenol dalam memurnikan enzim pada ikan blue fin tuna26.
Penelitian lain dilakukan untuk mengetahui efek pakan yang mengandung gossypol terhadap parameter darah dan struktur limpa pada tilapia, Oreochromis sp. yang dipelihara dalam sistem resirkulasi. Penelitian tersebut didasari oleh pendapat bahwa gossypol (C30H30O8) yang terkandung dalam biji kapas bersifat toksik bagi ikan. Hasil penelitian menunjukkan bahwa konsentrasi total dan gossypol bebas dalam plasma darah secara significant meningkat dengan meningkatnya level tepung biji kapas (CSM) (P < 0.05). Tidak ada gossypol yang ditemukan dalam darah pada ikan control. Terjadinya ikan immature dan eritrosit abnormal juga meningkat pada ikan yang diberi CSM dengan dosis 75 dan 100% bila dibandingkan dengan yang diberi dosis 0–50%. Limpa-somatic index ((bobot limpa/bobot tubuh) x100) tidak berbeda antara kontrol dengan yang diberi pakan CSM berdosis 50–100%. Abnormalitas pada limpa diantaranya adalah terjadinya deposisi haemosiderin dan pigmen melanin, proliferasi dari pusat melano-macrophage, deplesi limfosit, adanya vakuola dan area yang mengalami nekrosis pada ikan yang diberi dosis CSM 50–100%. Secara umum, efek patologik dari gossypol pada tilapia adalah rendahnya kandungan haemoglobin and haematokrit, berlimpahnya sel darah merah yang immatur atau polychromatocytes, abnormalitas pada morfologi limpa mirip seperti efek kekurangan vitamin E dan/atau vitamin C pada hasil penelitian yang lain24.
Pada spiny lobster (Panulirus interruptus) tidak seperti krustase pada umumnya, prophenoloxidase (proPO) dideteksi terdapat dalam plasma sel sebanyak 86·3%. Mekanisme aktifasi pada lobster ini adalah sama dengan sistem yang terdapat pada krustacea yang lain. Adanya haemosit lysate dapat mengindikasikan lokasi prophenoloxidase activating enzyme (PPAE) dalam haemosit. Enzim ini mentranform a serine-proteinase inaktif menjadi bentuk aktif5.
Tekanan akibat proses oksidasi merupakan dua fenomena dalam produksi makanan dan obat-obatan. Oleh karenanya dilakukan penelitian dengan menggunakan vitamin C, vitamin E, selenium dan senyawa fenol hasil ekstrak dari tanaman. Pada percobaan menggunakan sel kultur untuk mengetahui dampaknya sebagai antioksidan pada Southern Bluefin Tuna (SBT). Penelitian tersebut menyimpulkan bahwa karena pakan untuk SBT sudah cukup tinggi kandungan vitamin C dan E-nya, berdampak terhadap terjadinya shelf-life dan peningkatan stabilitas glutation perokidase selama dalam proses penyimpanan dalam cold storage14.
PUSTAKA
- Bakopoulos, V., Pearson, M., Volpatti, D., Gousmani, L., Adams, A., Galeotti, M. and Dimitriadis, G.J. 2003. Investigation of media formulations promoting differential antigen expression by Photobacterium damsela ssp. piscicida and recognition by sea bass, Dicentrarchus labrax (L.), immune sera. Journal of Fish Diseases : 26, 1–13
- Campos, F.M., Couto J.A., and Hogg,T.A. 2003. Influence of phenolic acids on growth and inactivation of Oenococcus oeni and Lactobacillus hilgardii. Journal of Applied Microbiology :94, 167–174
- Griva, E., Pessione, E., Divari, D., Valetti, F., Cavaletto, M.,Rossi, G.L., and Giunta, C. 2003. Phenol hydroxylase from Acinetobacter radioresistens S13: Isolation and characterization of the regulatory component. Eur. J. Biochem: 270, 1434–1440.
- Grossel, G.W. 2005. Kudoa neurophila in striped trumpeter: identification, diagnostic development and histopathology. Dissertation for the degree of Doctor of Philosophy. University of Tasmania.
- Loupez, J.H., Galvaun, T.G., Jimeunez, S.G., Clark, G.P., and Albores, F.V. 2003. In the spiny lobster (Panulirus interruptus) the prophenoloxidase is located in plasma not in haemocytes. Fish & Shellfish Immunology :14, 105–114. http://www.elsevier.com/locate/fsi
- Mao, X., Buchanan, I.D., and Stanley, S.J. 2006. Phenol removal from aqueous solution by fungal peroxidases. J. Environ. Eng. Sci./Rev. gen. sci. env. 5(S1): S103-S109
- Mulyasuryani, A., A. Wiryawan, R. Retnowati, S. Wardhani. 1997. Metode Sederhana untuk Monitoring Senyawa-senyawa Fenol di Perairan. Jurnal Penelitian Ilmu-ilmu Teknik (Engineering) Vol 9. No. 2. Fakultas MIPA Universitas Brawijaya. Malang.
- Gross, K.A., Morrison, R.N., Butler, R. and Nowak, B.F. 2004. Atlantic salmon, Salmo salar L., previously infected with Neoparamoeba sp. are not resistant to re-infection and have suppressed phagocyte function. Journal of Fish Diseases: 27, 47–56
- Lee, C., Jeon, S.H., Na, JG., Choi, YJ., and Park, K. 2002. Sensitivities of mRNA expression of vitellogenin, choriogenin and estrogen receptor by estrogenic chemicals in medaka, Oryzias latipes. Journal of Health Science, 48(5) 441-445.
- Bakopoulos, V., Volpatti, D., Gusmani, L.,Galeotti, M., Adams, A.., and Dimitriadis, G.J.. 2003. Vaccination trials of sea bass, Dicentrarchus labrax (L.), against Photobacterium damsela subsp. piscicida, using novel vaccine mixtures. Journal of Fish Diseases: 26, 77–90
- Isshiki, T., Nagano, T., Kanehira, K., and Suzuki, S. 2004. Distribution of marine birnavirus in cultured marine fish species from Kagawa Prefecture, Japan. Journal of Fish Diseases: 27, 89–98
- Venugopal, T., Mathavan, S., and Pandian, T.J. 2002. Molecular cloning of growth hormone encoding cDNA of Indian major carps by a modified rapid amplification of cDNA ends strategy. J. Biosci.: 27 261–272
- Villamil, L., Figueras, A., Aranguren, R., and Novoa, B. 2003. Non-specific immune response of turbot, Scophthalmus maximus (L.), experimentally infected with a pathogenic Vibrio pelagius. Journal of Fish Diseases: 26, 321–329
- Schuller, K.A. 2006. Using cell culture to identify antioxidants that protect farmed Southern Bluefin Tuna (SBT) against oxidative stress. Flinders University, School of Biological Sciences. The Biology Honours Year 2006. PROJECT BOOKLET
- Acunzo, F., Galli,C., Gentili, P., and Sergi, F. 2006. Mechanistic and steric issues in the oxidation of phenolic and non-phenolic compounds by laccase or laccasemediator systems. the case of bifunctional substrates. New J. Chem.:30, 583 –591
- De Luca, A., Sacchetta, P., Di Ilio, C., and Favaloro, B. 2005. Identification and analysis of the promoter region of the human methionine sulphoxide reductase a gene. Biochemical Journal Immediate Publication. Published on 14 Sep 2005 as manuscript BJ20050973.
- d’Acunzo, F., and Galli, C. 2003. First evidence of catalytic mediation by phenolic compounds in the laccase-induced oxidation of lignin models. Eur. J. Biochem. :270, 3634–3640
- Wahyuningsih. 2005. Pengaruh tirosin ,asam askorbat,enzim polifenol, xidase (ppo) terhadap perubahan warna kentang. Gema Teknologi, Media Informasi Sains dan Teknologi. Issn 0852 – 0232. Vol. 14 N0.2 Periode Oktober – April Tahun 2005
- Ba´rtfai, R., Egedi, S., Yue, G.H., Kova´cs., B., Urba´nyi, B., Tama´s, G., Horva´th, L., and Orba´n, L. 2003. Genetic analysis of two common carp broodstocks by RAPD and microsatellite markers. Aquaculture :219 ,157–167. www.elsevier.com/locate/aqua-online
- Mori, M., and Wakabayashi, M. 2000. Cytotoxicity evaluation of synthesized chemicals using suspension-cultured fish cells. Fisheries science, 66: 871-875
- Matsushita, Y., Suzuki, R., Nara, E., Yokohama, A., and Miyashita, K. 2000. antioxidant activity of polar carotenoids including astaxanthin-β-glucoside from marine bacterium on PC liposomes. Fisheries science, 66: 980-985
- Yoshie, Y., Wang, W., Petillo, D., and Suzuki, T. 2000. Distribution of catechins in Japanese seaweeds. Fisheries science, 66: 998-1000
- Heiska, I.C., Wahteristo, P., Kastilan, E.L., Bergelin, E., Bylund, G., and Isomaa, B. 2004. Effects of the wood extractive betulinol and 17b-oestradiol on reproduction in zebrafish, Danio rerio (Hamilton) – complications due to a bacterial infection. Journal of Fish Diseases:27, 267–276
- Garcia-Abiado, M.A., Mbahinzireki,G., Rinchard, J.,Lee, K.J., and Dabrowski, K. 2004. Effect of diets containing gossypol on blood parameters and spleen structure in tilapia, Oreochromis sp., reared in a recirculating system. Journal of Fish Diseases:, 27, 359–368
- Fujii, K., Urano, N., Kimura, S., Nomura, Y., and Karube, I. 2000. Microbial degradation of nonyphenol in some aquatic environments. Fisheries science, 66: 44-48
- Pong, C.Y., Chiou, T.K., Nieh, F.P., and Jiang, S.T. 2000. Purification and characterization of metmyoglobin reductase from ordinary muscle of blue fin tuna. Fisheries science, 66: 599-604
- Mariska, I, dan Husni, A. 2006. Perbaikan sifat genotipe melalui fusi protoplas pada tanaman lada, nilam, dan terung. Jurnal Litbang Pertanian, 25(55-60)
- deMeio, R.H., and Arnolt, R.I. 1944. Phenol conjugation, II. The conjugation by rat and cat tissues in vitro. The journal of fish biological chemistry. Downloaded from www.jbc.org on January 27, 2007
- Rustamsjah. 2001. Rekayasa biodegradasi fenol oleh Pseudomonas aeruginosa ATCC 27833. Makalah Falsafah Sains (PPs 702). Program Pasca Sarjana / S3. Institut Pertanian Bogor. Didownload tanggal 27 Januari 2007 via google.com
- Green, T.R. Significance of glucose oxidase in lignin degradation. Nature 268, 78 – 80 (07 July 1977); doi:10.1038/268078a0
- Anonim. 2000. Seri Iptek Pangan Volume 1: Teknologi, Produk, Nutrisi & Kemanan. Budi Widianarko, A. Rika Pratiwi, Ch. Retnaningsih (eds.). Jurusan Teknologi Pangan – Unika Soegijapranata, Semarang
- R. Sudradjat, G. Pari dan M.I. Iskandar. 2003. Pembuatan perekat fenolik dari lindi hitam yang dipekatkan dengan tanin atau fenol kristal (The Manufacture of Phenolic Glue From Black Liquor Concentrated With Tannin or Crystal Phenol). Buletin Penelitian Vol. 21 No. 2 Tahun 2003, P3THH Bogor
- Pasaribu, N. 2004. Minyak Buah Kelapa Sawit. Jurusan Kimia. Fakultas Matematika Dan Ilmu Pengetahuan Alam. Universitas Sumatera Utara. Download tanggal 27 Januari 2006
- Wikipedia. 2006. Fenol. Wikipedia Indonesia. Ensiklopedia bebas berbahasa Indonesia. (diakses : 18 Januari 2007, http : www.wikipedia.co.id).